- Artikel
- Veröffentlicht: 24. Mai 2021
SARS-CoV2-Infektion induziert langlebige Knochenmarkplasmazellen
beim Menschen
- Jackson S. Turner,
- Wooseob Kim,
- Elizaveta Kalaidina,
- Charles W. Goss,
- Adriana M. Rauseo,
- Aaron J. Schmitz,
- Lena Hansen,
- Alem Haile,
- Michael K. Klebert,
- Iskra Pusic,
- Jane A. O’Halloran,
- Rachel M. Presti &
- Ali H. Ellebedy
Natur volume 595, pages421–425 (2021) Diesen Artikel zitieren
- 585k Zugriffe
- 2 Zitate
- 9961 Altmetric
- Metrikdetails
Abstrakt
Langlebige Knochenmarkplasmazellen (BMPCs) sind eine persistente und essentielle Quelle für schützende Antikörper1,2,3,4,5,6,7. Personen, die sich von COVID-19 erholt haben, haben ein wesentlich geringeres Risiko einer erneuten Infektion mit SARS-CoV28,9,10. Nichtsdestotrotz wurde berichtet, dass die Spiegel von Anti-SARS-CoV2-Serumantikörpern in den ersten Monaten nach der Infektion rapide abnehmen, was Bedenken aufkommen lässt, dass langlebige BMPCs möglicherweise nicht erzeugt werden und eine humorale Immunität gegen SARS-CoV-2 kurzlebig sein könnte 11,12,13
Hier zeigen wir, dass bei Rekonvaleszenten, die leichte SARS-CoV-2-Infektionen (n = 77 ) erlebt hatten, die Spiegel der Serum-Anti-SARS-CoV-2-Spike-Protein (S)-Antikörper in den ersten 4 Monaten nach der Infektion schnell abnahmen und dann in den folgenden 7 Monaten allmählicher abnahmen und mindestens 11 Monate nach der Infektion nachweisbar blieben. Anti-S-Antikörpertiter korrelierten mit der Häufigkeit von S-spezifischen Plasmazellen in Knochenmarkaspiraten von 18 Personen, die sich 7 bis 8 Monate nach der Infektion von COVID-19 erholt hatten.
S-spezifische BMPCs wurden in Aspiraten von 11 gesunden Personen ohne SARS-CoV-2-Infektion in der Anamnese nicht nachgewiesen.
Wir zeigen, dass S-bindende BMPCs ruhend sind, was darauf hindeutet, dass sie Teil eines stabilen Kompartiments sind. Konsequenterweise wurden bei den Rekonvaleszenten zirkulierende Ruhegedächtnis-B-Zellen nachgewiesen, die gegen SARS-CoV-2 S gerichtet waren.
Insgesamt deuten unsere Ergebnisse darauf hin, dass eine leichte Infektion mit SARS-CoV-2 beim Menschen ein robustes antigenspezifisches, langlebiges humorales Immungedächtnis induziert.
Hauptsächlich
Reinfektionen durch saisonale Coronaviren treten 6 bis 12 Monate nach der vorherigen Infektion auf, was darauf hindeutet, dass die schützende Immunität gegen diese Viren kurzlebig sein kann 14,15.
Frühe Berichte, die in den ersten Monaten nach der Infektion schnell abnehmende Antikörpertiter bei Personen dokumentierten, die sich von COVID-19 erholt hatten, deuteten darauf hin, dass die schützende Immunität gegen SARS-CoV-2 ähnlich vorübergehend sein könnte 11,12,13. Es wurde auch vorgeschlagen, dass eine Infektion mit SARS-CoV-2 keine funktionelle Keimzentrumsreaktion hervorrufen könnte, die die Erzeugung langlebiger Plasmazellen beeinträchtigen würde.3,4,5,7,16.
Neuere Berichte zur Analyse von Proben, die etwa 4 bis 6 Monate nach der Infektion entnommen wurden, deuten darauf hin, dass die SARS-CoV-2-Antikörpertiter langsamer abnehmen als in den ersten Monaten nach der Infektion.8,17,18,19,20,21.
Dauerhafte Serumantikörpertiter werden von langlebigen Plasmazellen aufrechterhalten – nicht replizierenden, antigenspezifischen Plasmazellen, die lange nach der Clearance des Antigens im Knochenmark nachgewiesen werden1,2,3,4,5,6,7. Wir wollten herausfinden, ob sie bei Rekonvaleszenten etwa 7 Monate nach der SARS-CoV-2-Infektion nachweisbar waren.
Biphasischer Zerfall von Anti-S-Antikörpertitern
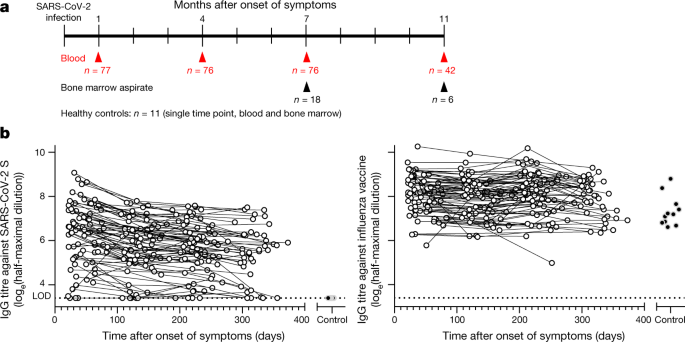
Blutproben wurden etwa 1 Monat nach Beginn der Symptome von 77 Personen entnommen, die sich von COVID-19 erholten (49% weiblich, 51% männlich, Durchschnittsalter 49 Jahre), von denen die Mehrheit eine leichte Erkrankung erlitten hatte (7,8% hospitalisiert, Extended Data Tables 1, 2).
Follow-up-Blutproben wurden dreimal in abständen etwa drei Monaten entnommen. Zwölf Rekonvaleszenten erhielten zwischen den letzten beiden Zeitpunkten entweder den BNT162b2 (Pfizer) oder den mRNA-1273 (Moderna) SARS-CoV-2-Impfstoff; diese Proben nach der Impfung wurden nicht in unsere Analysen einbezogen.
Darüber hinaus wurden Knochenmarkaspirate von 18 der rekonvaleszenten Personen 7 bis 8 Monate nach der Infektion und von 11 gesunden Freiwilligen ohne SARS-CoV-2-Infektion oder Impfung in der Vorgeschichte gesammelt.
Follow-up-Knochenmarkaspirate wurden von 5 der 18 rekonvaleszenten Personen und von 1 zusätzlichen Rekonvaleszentenspender etwa 11 Monate nach der Infektion gesammelt (Abb. 1a, Extended Data Tables 3, 4).
Wir führten zunächst eine Längsschnittanalyse von zirkulierenden Anti-SARS-CoV-2-Serumantikörpern durch.
Während Anti-SARS-CoV-2 Spike Protein (S) IgG-Antikörper im Blut von Kontrollpersonen nicht nachweisbar waren, hatten 74 der 77 Rekonvaleszenten etwa 1 Monat nach Beginn der Symptome nachweisbare Serumtiter.
Zwischen 1 und 4 Monaten nach Symptombeginn nahmen die gesamten Anti-S-IgG-Titer von einem mittleren Protokoll abe-transformierte halbmaximale Verdünnung von 6,3 bis 5,7 (mittlere Differenz 0,59 ± 0,06, P < 0,001).
Im Intervall zwischen 4 und 11 Monaten nach Symptombeginn verlangsamte sich jedoch die Abnahmerate und die mittleren Titer sanken von 5,7 auf 5,3 (mittlere Differenz 0,44 ± 0,10, P < 0,001; Abb. 1a).
Im Gegensatz zu den Anti-S-Antikörpertitern wurden IgG-Titer gegen den inaktivierten Impfstoff gegen das inaktivierte saisonale Influenzavirus 2019–2020 bei allen Kontrollpersonen und Personen, die sich von COVID-19 erholten, nachgewiesen und gingen im Laufe der Studie viel allmählicher, wenn überhaupt, zurück, wobei die mittleren Titer von 8,0 auf 7,9 sanken (mittlere Differenz 0,16 ± 0,06, P = 0,042) und 7,9 bis 7,8 (mittlere Differenz 0,02 ± 0,08, P = 0,997) über die 1- bis 4-Monats- bzw. 4-zu-11-Monatsintervalle nach Symptombeginn (Abb. 1b).
Induktion von S-bindenden langlebigen BMPCs
Der relativ schnelle frühe Rückgang der Anti-S-IgG-Spiegel, gefolgt von einer langsameren Abnahme, steht im Einklang mit einem Übergang von Serumantikörpern, die von kurzlebigen Plasmablasten abgesondert werden, zur Sekretion durch eine kleinere, aber persistentere Population langlebiger Plasmazellen, die später in der Immunantwort erzeugt werden.
Die Mehrheit dieser letzteren Population lebt im Knochenmark1,2,3,4,5,6. Um zu untersuchen, ob Personen, die sich von COVID-19 erholt hatten, ein virusspezifisches langlebiges BMPC-Kompartiment entwickelten, untersuchten wir Knochenmarkaspirate, die etwa 7 und 11 Monate nach der Infektion auf Anti-SARS-CoV-2 S-spezifische BMPCs erhalten wurden.
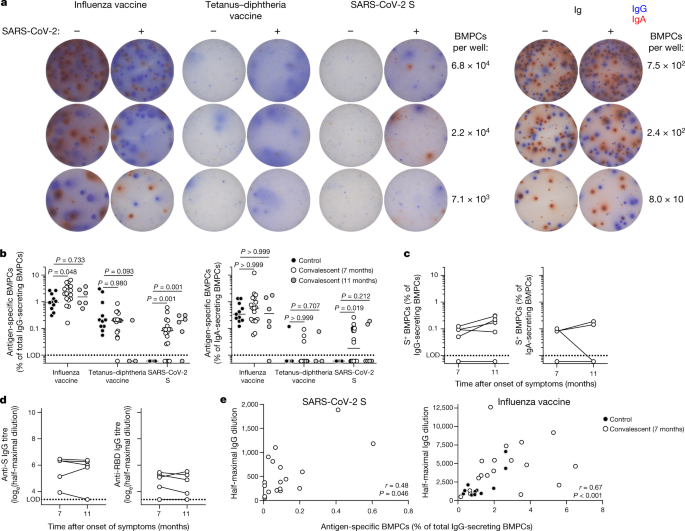
Wir haben BMPCs aus den Aspiraten magnetisch angereichert und dann die Häufigkeit derjenigen quantifiziert, die IgG und IgA sezernieren, die gegen den Influenzavirusimpfstoff 2019-2020, den Tetanus-Diphtherie-Impfstoff und SARS-CoV-2 S gerichtet sind, mittels enzymgebundenem Immunsorbent-Spot-Assay (ELISpot) (Abb. 2a).
Die Häufigkeit von Influenza- und Tetanus-Diphtherie-Impfstoff-spezifischen BMPCs war zwischen Kontrollpersonen und Rekonvaleszenten vergleichbar.
gG- und IgA-sezernierende S-spezifische BMPCs wurden bei 15 bzw. 9 der 19 rekonvaleszenten Individuen nachgewiesen, jedoch nicht bei keiner der 11 Kontrollpersonen (Abb. 2b).
Bemerkenswerterweise hatte keine der Kontrollpersonen oder Rekonvaleszenten zum Zeitpunkt der Knochenmarkentnahme nachweisbare S-spezifische Antikörper-sezernierende Zellen im Blut, was darauf hindeutet, dass die nachgewiesenen BMPCs Knochenmark-residente Zellen darstellen und keine Kontamination durch zirkulierende Plasmablasten.
Die Häufigkeit von Anti-S-IgG-BMPCs war bei den 5 Rekonvaleszenten, die etwa 4 Monate später ein zweites Mal untersucht wurden, stabil, und die Häufigkeit von Anti-S-IgA-BMPCs war bei 4 dieser 5 Personen stabil, aber bei einem Individuum unter die Nachweisgrenze gesunken (Abb. 2c).
In Übereinstimmung mit ihren stabilen BMPC-Frequenzen blieben die Anti-S-IgG-Titer bei den 5 Rekonvaleszenten zwischen 7 und 11 Monaten nach Symptombeginn konsistent.
IgG-Titer, die gegen die Rezeptor-Bindungsdomäne (RBD) des S-Proteins – ein primäres Ziel neutralisierender Antikörper – gemessen wurden, wurden bei 4 der 5 rekonvaleszenten Personen nachgewiesen und waren auch zwischen 7 und 11 Monaten nach Symptombeginn stabil (Abb. 2d).
Die Häufigkeit von Anti-S-IgG-BMPCs zeigte eine bescheidene, aber signifikante Korrelation mit zirkulierenden Anti-S-IgG-Titern 7-8 Monate nach Beginn der Symptome bei Rekonvaleszenten, die mit der langfristigen Aufrechterhaltung der Antikörperspiegel durch diese Zellen übereinstimmte (r = 0,48, P = 0,046).
In Übereinstimmung mit früheren Berichten22,23,24zeigten die Häufigkeiten von Influenza-Impfstoff-spezifischen IgG-BMPCs und Antikörpertitern eine starke und signifikante Korrelation (r = 0,67, P < 0,001; Abb. 2e).
Neun der Aspirate von Kontrollpersonen und 12 der 18 Aspirate, die 7 Monate nach Symptombeginn von Rekonvaleszenten gesammelt wurden, ergaben eine ausreichende Anzahl von BMPCs für zusätzliche Analysen durch Durchflusszytometrie. Wir färbten diese Proben intrazellulär mit fluoreszierend markierten S- und Influenzavirus-Hämagglutinin-Sonden (HA), um antigenspezifische BMPCs zu identifizieren und zu charakterisieren.
Als Kontrollen färbten wir auch intrazellulär periphere mononukleäre Blutzellen (PBMCs) von gesunden Probanden eine Woche nach der Impfung gegen SARS-CoV-2 oder das saisonale Influenzavirus (Abb. 3a, Extended Data Abb. 1a–c).
In Übereinstimmung mit den ELISpot-Daten wurden niedrige Frequenzen von S-bindenden BMPCs in 10 der 12 Proben von Rekonvaleszenten nachgewiesen, jedoch nicht in einer der 9 Kontrollproben (Abb. 3b).
Obwohl sowohl kürzlich erzeugte zirkulierende Plasmablasten als auch S- und HA-bindende BMPCs BLIMP-1 exprimierten, unterschieden sich die BMPCs durch ihre mangelnde Expression von Ki-67 – was auf einen Ruhezustand hinweist – sowie durch höhere CD38-Spiegel (Abb. 3c).

Abb. 3: SARS-CoV-2 S-bindende BMPCs sind ruhend und unterscheiden sich von zirkulierenden Plasmablasten.
Robuste S-Bindungsspeicher-B-Zellantwort
Gedächtnis-B-Zellen bilden den zweiten Arm des humoralen Immungedächtnisses. Nach erneuter Exposition gegenüber einem Antigen dehnen sich Gedächtnis-B-Zellen schnell aus und differenzieren sich zu Antikörper-sezernierenden Plasmablasten.
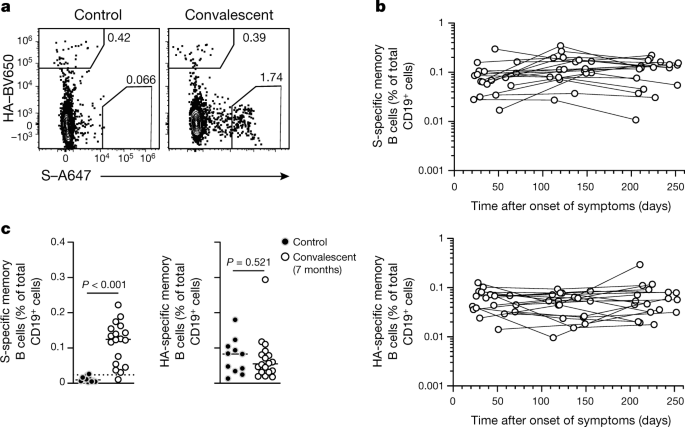
Wir untersuchten die Häufigkeit von SARS-CoV-2-spezifischen zirkulierenden Gedächtnis-B-Zellen bei Personen, die sich von COVID-19 erholten, und bei gesunden Kontrollpersonen.
Wir färbten PBMCs mit fluoreszierend markierten S-Sonden und bestimmten die Frequenz von S-bindenden Speicher-B-Zellen unter isotypgeschalteten IgDloCD20-Speicher-B-Zellen durch Durchflusszytometrie.
Zum Vergleich haben wir die Zellen mit fluoreszierend markierten Influenzavirus-HA-Sonden co-gefärbt (Abb. 4a, Extended Data Abb. 1d).
S-bindende Gedächtnis-B-Zellen wurden bei rekonvaleszenten Personen in der ersten Probe identifiziert, die etwa einen Monat nach Beginn der Symptome gesammelt wurde, mit vergleichbaren Häufigkeiten wie Influenza-HA-bindende Gedächtnis-B-Zellen (Abb. 4b). S-bindende Gedächtnis-B-Zellen wurden für mindestens 7 Monate nach Symptombeginn beibehalten und waren bei signifikant höheren Frequenzen im Vergleich zu gesunden Kontrollen vorhanden – vergleichbar mit den Häufigkeiten von Influenza-HA-bindenden Gedächtnis-B-Zellen, die in beiden Gruppen identifiziert wurden (Abb. 4c).+
Diskussion
Diese Studie wollte herausfinden, ob eine Infektion mit SARS-CoV-2 antigenspezifische langlebige BMPCs beim Menschen induziert.
Wir haben SARS-CoV-2 S-spezifische BMPCs in Knochenmarkaspiraten von 15 von 19 Rekonvaleszenten und in keinem der 11 Kontrollteilnehmer nachgewiesen.
Die Häufigkeit von Anti-S-IgG-BMPCs korrelierte 7-8 Monate nach der Infektion moderat mit den Serum-IgG-Titern. Die phänotypische Analyse mittels Durchflusszytometrie zeigte, dass S-bindende BMPCs ruhig waren und ihre Häufigkeiten in 5 gepaarten Aspiraten, die 7 und 11 Monate nach Symptombeginn gesammelt wurden, weitgehend konsistent waren.
Insbesondere haben wir keine S-bindenden Zellen unter Plasmablasten in Blutproben nachgewiesen, die gleichzeitig mit den Knochenmarkaspiraten durch ELISpot oder Durchflusszytometrie in einer der Rekonvaleszenten- oder Kontrollproben gesammelt wurden.
Zusammen deuten diese Daten darauf hin, dass eine leichte SARS-CoV-2-Infektion eine langlebige BMPC-Reaktion induziert.
Darüber hinaus zeigten wir, dass S-bindende Gedächtnis-B-Zellen im Blut von Personen, die sich von COVID-19 erholt hatten, ähnlich häufig vorhanden waren wie diejenigen, die gegen das Influenzavirus HA gerichtet waren. Insgesamt stimmen unsere Ergebnisse mit einer SARS-CoV-2-Infektion überein, die eine kanonische T-Zell-abhängige B-Zell-Reaktion hervorruft, bei der ein früher vorübergehender Ausbruch extrafollikulärer Plasmablasten eine Welle von Serumantikörpern erzeugt, die relativ schnell abnehmen. Es folgen stabiler gehaltene Serumantikörperspiegel, die durch langlebige BMPCs unterstützt werden.
Obwohl dieser allgemeine Trend die Serumantikörperdynamik der Mehrheit der Teilnehmer erfasst, beobachteten wir, dass bei drei Teilnehmern die Anti-S-Serumantikörpertiter zwischen 4 und 7 Monaten nach Beginn der Symptome zunahmen, nachdem sie zunächst zwischen 1 und 4 Monaten abgenommen hatten.
Dies könnte stochastisches Rauschen sein, könnte eine erhöhte Nettobindungsaffinität darstellen, da frühe Plasmablasten-abgeleitete Antikörper durch solche aus affinitätsgereiften BMPCs ersetzt werden, oder könnte einen Anstieg der Antikörperkonzentration durch die widere Begegnung mit dem Virus darstellen (obwohl keiner der Teilnehmer in unserer Kohorte ein zweites Mal positiv getestet wurde).
Obwohl Anti-S-IgG-Titer in der Rekonvaleszentenkohorte im Intervall zwischen 4 und 11 Monaten nach Symptombeginn relativ stabil waren, nahmen sie im Gegensatz zu Anti-Influenza-Virus-Impfstofftitern messbar ab. Es ist möglich, dass dieser Rückgang ein endgültiges Abklingen früher Plasmablasten-abgeleiteter Antikörper widerspiegelt.
Es ist auch möglich, dass der fehlende Rückgang der Influenza-Titer auf eine Verstärkung durch Exposition gegenüber Influenza-Antigenen zurückzuführen ist. Unsere Daten deuten darauf hin, dass eine SARS-CoV-2-Infektion beim Menschen eine Keimzentrumsreaktion induziert, da angenommen wird, dass langlebige BMPCs überwiegend aus dem Keimzentrum stammen 7.
Dies steht im Einklang mit einer kürzlich durchgeführten Studie, die erhöhte Somatik-Hypermutation in Gedächtnis-B-Zellen berichtete, die auf die RBD von SARS-CoV-2 S bei Rekonvaleszenten nach 6 Monaten im Vergleich zu 1 Monat nach der Infektion abzielen 20.
Unseres Wissens liefert die aktuelle Studie den ersten direkten Nachweis für die Induktion von antigenspezifischen BMPCs nach einer Virusinfektion beim Menschen.
Wir erkennen jedoch einige Einschränkungen an. Obwohl wir anti-S-IgG-Antikörper im Serum mindestens 7 Monate nach der Infektion bei allen 19 Rekonvaleszenten,- und -spendern, von denen wir Knochenmarkaspirate erhalten haben, konnten wir bei 4 Spendern keine S-spezifischen BMPCs nachweisen.
Serum-Anti-S-Antikörpertiter in diesen vier Spendern waren niedrig, was darauf hindeutet, dass S-spezifische BMPCs möglicherweise bei sehr niedrigen Frequenzen vorhanden sein können, die unterhalb der Nachweisgrenze des Assays liegen.
Eine weitere Einschränkung ist, dass wir den Anteil der in unserer Studie nachgewiesenen S-bindenden BMPCs, der neutralisierende Antikörper kodiert, nicht kennen.
SARS-CoV-2 S Protein ist das Hauptziel neutralisierender Antikörper 17,25,26,27,28,29,30 und ein Zusammenhang zwischen Serum-Anti-S-IgG-Bindung und Neutralisationstitern wurde dokumentiert 17,31.
Weitere Studien werden erforderlich sein, um die Epitope, auf die BMPCs und Gedächtnis-B-Zellen abzielen, sowie ihre klonale Verwandtschaft zu bestimmen.
Obwohl unsere Daten eine robuste Induktion langlebiger BMPCs nach einer Infektion mit SARS-CoV-2 dokumentieren, ist es wichtig zu beachten, dass unsere Rekonvaleszenten meist leichte Infektionen erlebten.
Unsere Daten stimmen mit einem Bericht überein, der zeigt, dass Personen, die sich schnell von einer symptomatischen SARS-CoV-2-Infektion erholten, eine robuste humorale Immunantwort erzeugten 32.
Es ist möglich, dass schwerere SARS-CoV-2-Infektionen aufgrund von dysregulierten humoralen Immunantworten zu einem anderen Ergebnis in Bezug auf langlebige BMPC-Frequenzen führen könnten.
Dies war jedoch bei Überlebenden des Ebola-Virusausbruchs 2014 in Westafrika nicht der Fall, bei denen eine schwere Virusinfektion lang anhaltende antigenspezifische Serum-IgG-Antikörper induzierte 33.
Langlebige BMPCs bieten dem Wirt eine persistente Quelle vorgeformter schützender Antikörper und werden daher benötigt, um einen dauerhaften Immunschutz aufrechtzuerhalten. Die Langlebigkeit von Serum-Anti-S-IgG-Antikörpern ist jedoch nicht die einzige Determinante dafür, wie dauerhaft der immunvermittelte Schutz sein wird. Isotyp-geschaltete Gedächtnis-B-Zellen können sich nach erneuter Exposition gegenüber einem Krankheitserreger schnell in Antikörper-sezernierende Zellen differenzieren und bieten eine zweite Verteidigungslinie34. Ermutigend ist, dass die Häufigkeit der S-bindenden zirkulierenden Gedächtnis-B-Zellen 7 Monate nach der Infektion ähnlich der von B-Zellen war, die gegen zeitgenössische Influenza-HA-Antigene gerichtet waren.
Insgesamt liefern unsere Daten starke Beweise dafür, dass eine SARS-CoV-2-Infektion beim Menschen die beiden Arme des humoralen Immungedächtnisses robust etabliert: langlebige BMPCs und Gedächtnis-B-Zellen.
Diese Ergebnisse liefern einen Immunogenität-Benchmark für SARS-CoV-2-Impfstoffe und eine Grundlage für die Bewertung der Haltbarkeit primärer humoraler Immunantworten, die beim Menschen nach Virusinfektionen induziert werden.
Methodik
Daten-Reporting
Es wurden keine statistischen Methoden verwendet, um den Stichprobenumfang vorzubestimmen. Die Experimente wurden nicht randomisiert und die Forscher wurden während der Ergebnisbewertung nicht verblindet.
Probenentnahme, -Aufbereitung und -Lagerung
Alle Studien wurden vom Institutional Review Board der Washington University in St. Louis genehmigt.
Von allen Beteiligten wurde die schriftliche Zustimmung eingeholt.
Siebenundsiebzig Teilnehmer, die sich von einer SARS-CoV-2-Infektion erholt hatten, und elf Kontrollpersonen ohne EINE SARS-CoV-2-Infektion in der Vorgeschichte wurden aufgenommen (Extended Data Tables 1, 4).
Blutproben wurden in EDTA-Röhrchen entnommen und PBMCs wurden durch Dichtegradientenzentrifugation über Ficoll 1077 (GE) oder Lymphopure (BioLegend) angereichert.
Die verbleibenden roten Blutkörperchen wurden mit Ammoniumchlorid-Lysepuffer lysiert, und Zellen wurden sofort verwendet oder in 10% Dimethylsulfoxid im fetalen Rinderserum (FBS) kryokonserviert.
Knochenmarkaspirate von etwa 30 ml wurden in EDTA-Röhrchen aus dem Beckenkamm von 18 Personen, die sich von COVID-19 erholt hatten, und den Kontrollpersonen gesammelt.
Mononukleäre Knochenmarkzellen wurden durch Dichtegradientenzentrifugation über Ficoll 1077 angereichert, und die verbleibenden roten Blutkörperchen wurden mit Ammoniumchloridpuffer (Lonza) lysiert und mit phosphatgepufferter Kochsalzlösung (PBS) gewaschen, ergänzt mit 2% FBS und 2 mM EDTA.
Knochenmarkplasmazellen wurden aus mononukleäre Knochenmarkzellen mit dem CD138 Positive Selektion Kit II (Stammzelle) angereichert und sofort für ELISpot oder kryokonserviert in 10% Dimethylsulfoxid in FBS verwendet.
Antigene
Rekombinantes lösliches Spike-Protein (S) und seine Rezeptor-bindende Domäne (RBD), abgeleitet von SARS-CoV-2, wurden wie zuvor beschrieben exprimiert35.
Kurz gesagt, Säugetierzell-Codon-optimierte Nukleotidsequenzen, die für die lösliche Version von S Kodierern (GenBank: MN908947.3, Aminosäuren (aa) 1–1,213), einschließlich einer C-terminalen Thrombinspaltungsstelle, einer T4-Foldon-Trimerisierungsdomäne und eines Hexahistidin-Tags, das in den Säugetierexpressionsvektor pCAGGS geklont wurde.
Die S-Proteinsequenz wurde modifiziert, um die polybasischische Spaltungsstelle (RRAR bis A) zu entfernen, und es wurden zwei stabilisierende Mutationen eingeführt (K986P und V987P, Wildtyp-Nummerierung).
Die RBD wurden zusammen mit dem Signalpeptid (aa 1–14) und einem Hexahistidin-Tag in den Säugetierexpressionsvektor pCAGGS geklont.
Rekombinante Proteine wurden in Expi293F-Zellen (Thermo Fisher Scientific) durch Transfektion mit gereinigter DNA unter Verwendung des ExpiFectamine 293 Transfektion Kit (Thermo Fisher Scientific) hergestellt.
Überstände aus transfizierten Zellen wurden 3 (für S) oder 4 (für RBD) Tage nach der Transfektion gesammelt, und rekombinante Proteine wurden mit Ni-NTA-Agarose (Thermo Fisher Scientific) gereinigt, dann in PBS gepuffert und mit Amicon Ultracel Zentrifugalfiltern (EMD Millipore) konzentriert.
Für die Durchflusszytometrie-Färbung wurde rekombinantes S mit Alexa Fluor 647- oder DyLight 488-NHS-Ester (Thermo Fisher Scientific) markiert; überschüssige Alexa Fluor 647 und DyLight 488 wurden mit 7-kDa- bzw. 40-kDa-Zeba-Entsalzungssäulen entfernt (Pierce).
Rekombinante HA von A/Michigan/45/2015 (aa 18–529, Immune Technology) wurde mit DyLight 405-NHS-Ester (Thermo Fisher Scientific) markiert; überschüssiges DyLight 405 wurde mit 7-kDa Zeba Entsalzungssäulen entfernt. Rekombinante HA von A/Brisbane/02/2018 (aa 18–529) und B/Colorado/06/2017 (aa 18–546) (beide Immune Technology) wurden mit dem EZ-Link Micro NHS-PEG4-Biotinylierungskit (Thermo Fisher Scientific) biotinyliert;
überschüssiges Biotin wurde mit 7-kDa Zeba Entsalzungssäulen entfernt.
ELISpot
Die Platten wurden mit Flucelvax Quadrivalent 2019/2020 saisonalem Grippevirusimpfstoff (Sequiris), Tetanus-Diphtherie-Impfstoff (Grifols), rekombinantem S oder anti-humanem Ig beschichtet.
Direkt ex vivo ELISpot wurde durchgeführt, um die Anzahl der gesamten, impfstoffbindenden oder rekombinanten S-bindenden IgG- und IgA-sezernierenden Zellen in BMPC- und PBMC-Proben mit IgG/IgA-Doppelfarben-ELISpot-Kits (Cellular Technology) gemäß den Anweisungen des Herstellers zu bestimmen.
ELISpot-Platten wurden mit einem ELISpot-Zähler (Cellular Technology) analysiert.
ELISA
Die Assays wurden in 96-Well-Platten (MaxiSorp, Thermo Fisher Scientific) durchgeführt, die mit 100 μl Flucelvax 2019/2020 oder rekombinantem S in PBS beschichtet waren, und die Platten wurden über Nacht bei 4 °C inkubiert. Die Platten wurden dann mit 10% FBS und 0,05% Tween-20 in PBS blockiert.
Serum oder Plasma wurden seriell in Blockierpuffer verdünnt und den Platten zugesetzt. Die Platten wurden 90 min bei Raumtemperatur inkubiert und dann 3 mal mit 0,05% Tween-20 in PBS gewaschen.
Ziegen-Anti-Human-IgG-HRP (Jackson ImmunoResearch, 1:2.500) wurde in Blockierungspuffer verdünnt, bevor es zu Den Bohrbrunnen gegeben und für 60 Minuten bei Raumtemperatur inkubiert wurde. Die Platten wurden 3 mal mit 0,05% Tween-20 in PBS gewaschen und dann 3 mal mit PBS gewaschen, bevor o-Phenylendiamindihydrochloridperoxidase-Substrat (Sigma-Aldrich) hinzugefügt wurde.
Reaktionen wurden durch die Zugabe von 1 M HCl gestoppt.
Optische Dichtemessungen wurden bei 490 nm durchgeführt.
Die halbmaximale Bindungsverdünnung für jede Serum- oder Plasmaprobe wurde mittels nichtlinearer Regression berechnet (GraphPad Prism v.8). Die Nachweisgrenze wurde mit 1:30 definiert.
Statistik
Spearmans Korrelationskoeffizienten wurden geschätzt, um die Beziehung zwischen 7-monatigen Anti-S- und Anti-Influenza-Virus-Impfstoff-IgG-Titern und den Häufigkeiten von BMPCs, die IgG-spezifisch für S bzw. für Influenzavirus-Impfstoffe sezernieren, zu bewerten.
Mittelwerte und paarweise Unterschiede der Antikörpertiter zu jedem Zeitpunkt wurden mit einer linearen gemischten Modellanalyse mit einer autoregressiven Kovarianzstruktur erster Ordnung geschätzt.
Die Zeit seit Symptombeginn wurde als kategorischer fixer Effekt für die 4 verschiedenen Probenzeitpunkte im Abstand von etwa 3 Monaten behandelt. P-Werte wurden für mehrere Vergleiche mit Tukeys Methode angepasst.
Alle Analysen wurden mit SAS v.9.4 (SAS Institute) und Prism v.8.4 (GraphPad) durchgeführt, und P-Werte von weniger als 0,05 wurden als signifikant angesehen.
Durchflusszytometrie
Die Färbung für die Durchflusszytometrie-Analyse wurde mit kryokonservierten magnetisch angereicherten BMPCs und kryokonservierten PBMCs durchgeführt.
Für die BMPC-Färbung wurden die Zellen 30 min lang auf Eis mit CD45-A532 (HI30, Thermo Fisher Scientific, 1:50), CD38-BB700 (HIT2, BD Horizon, 1:500), CD19-PE (HIB19, 1:200), CXCR5-PE-Dazzle 594 (J252D4, 1:50), CD71-PE-Cy7 (CY1G4, 1:400), CD20-APC-Fire750 (2H7, 1:400), CD3-APC-Fire810 (SK7, 1:50) und Zombie Aqua (alle BioLegend) verdünnt in Brilliant Stain Buffer (BD Horizon) gefärbt.
Die Zellen wurden zweimal mit 2% FBS und 2 mM EDTA in PBS (P2) gewaschen, mit dem True Nuclear Permeabilization Kit (BioLegend) für 1 h fixiert, zweimal mit Perm/Waschpuffer gewaschen, 1h mit DyLight 405-konjugiertem rekombinantem HA von A/Michigan/45/2015, DyLight 488- und Alexa 647-konjugiertem S, Ki-67-BV711 (Ki-67, 1:200, BioLegend) und BLIMP-1-A700 (646702, 1:50, F&E), zweimal mit Perm/Waschpuffer gewaschen und in P2 resuspendiert. +
Für die Färbung der Gedächtnis-B-Zellen wurden PBMCs 30 Minuten lang auf Eis mit biotinylierten rekombinanten HAs in P2 verdünnt, zweimal gewaschen, dann 30 Minuten auf Eis mit Alexa 647-konjugiertem S, IgA-FITC (M24A, Millipore, 1:500), IgG-BV480 (Ziegenpolyklonal, Jackson ImmunoResearch, 1:100), IgD-SB702 (IA6-2, Thermo Fisher Scientific, 1:50), CD38-BB700 (HIT2, BD Horizon, 1:500), CD20-Pacific Blue (2H7, 1:400), CD4-BV570 (OKT4, 1:50), CD24-BV605 (ML5, 1:100), Streptavidin-BV650, CD19-BV750 (HIB19, 1:100), CD71-PE (CY1G4, 1:400), CXCR5-PE-Dazzle 594 (J252D4, 1:50), CD27-PE-Cy7 (O323, 1:200), IgM-APC-Fire750 (MHM-88, 1:100), CD3-APC-Fire810 (SK7, 1:50) und Zombie NIR (alle BioLegend) in Brilliant Stain Buffer (BD Horizon) verdünnt und zweimal mit P2 gewaschen. Zellen wurden auf einer Aurora mit SpectroFlo v.2.2 (Cytek) erworben.
Die Daten der Durchflusszytometrie wurden mit FlowJo v.10 (Treestar) analysiert. In jedem Experiment wurden PBMCs von Rekonvaleszenten und Kontrollpersonen eingeschlossen.
Zusammenfassung der Berichterstattung
Weitere Informationen zum Forschungsdesign finden Sie in der Nature Research Reporting Summary, die mit diesem Artikel verknüpft ist.
Datenverfügbarkeit
Relevante Daten sind auf begründete Anfrage beim entsprechenden Autor erhältlich.
Referenzen
- 1.Benner, R., Meima, F., van der Meulen, G. M. & van Muiswinkel, W. B. Antibody formation in mouse bone marrow. I. Evidence for the development of plaque-forming cells in situ. Immunology 26, 247–255 (1974).CAS PubMed PubMed Central Google Scholar
- 2.Manz, R. A., Thiel, A. & Radbruch, A. Lifetime of plasma cells in the bone marrow. Nature 388, 133–134 (1997).ADS CAS Article Google Scholar
- 3.Slifka, M. K., Antia, R., Whitmire, J. K. & Ahmed, R. Humoral immunity due to long-lived plasma cells. Immunity 8, 363–372 (1998).CAS Article Google Scholar
- 4.Hammarlund, E. et al. Duration of antiviral immunity after smallpox vaccination. Nat. Med. 9, 1131–1137 (2003).CAS Article Google Scholar
- 5.Halliley, J. L. et al. Long-lived plasma cells are contained within the CD19−CD38hiCD138 subset in human bone marrow. Immunity 43, 132–145 (2015).+CAS Article Google Scholar
- 6.Mei, H. E. et al. A unique population of IgG-expressing plasma cells lacking CD19 is enriched in human bone marrow. Blood 125, 1739–1748 (2015).CAS Article Google Scholar
- 7.Nutt, S. L., Hodgkin, P. D., Tarlinton, D. M. & Corcoran, L. M. The generation of antibody-secreting plasma cells. Nat. Rev. Immunol. 15, 160–171 (2015).CAS Article Google Scholar
- 8.Hall, V. J. et al. SARS-CoV-2 infection rates of antibody-positive compared with antibody-negative health-care workers in England: a large, multicentre, prospective cohort study (SIREN). Lancet 397, 1459–1469 (2021).CAS Article Google Scholar
- 9.Houlihan, C. F. et al. Pandemic peak SARS-CoV-2 infection and seroconversion rates in London frontline health-care workers. Lancet 396, e6–e7 (2020).CAS Article Google Scholar
- 10.Lumley, S. F. et al. Antibodies to SARS-CoV-2 are associated with protection against reinfection. Preprint at https://doi.org/10.1101/2020.11.18.20234369 (2020).
- 11.Long, Q.-X. et al. Clinical and immunological assessment of asymptomatic SARS-CoV-2 infections. Nat. Med. 26, 1200–1204 (2020).CAS Article Google Scholar
- 12.Ibarrondo, F. J. et al. Rapid decay of anti-SARS-CoV-2 antibodies in persons with mild Covid-19. N. Engl. J. Med. 383, 1085–1087 (2020).Article Google Scholar
- 13.Seow, J. et al. Longitudinal observation and decline of neutralizing antibody responses in the three months following SARS-CoV-2 infection in humans. Nat. Microbiol. 5, 1598–1607 (2020).CAS Article Google Scholar
- 14.Edridge, A. W. D. et al. Seasonal coronavirus protective immunity is short-lasting. Nat. Med. 26, 1691–1693 (2020).Article Google Scholar
- 15.Callow, K. A., Parry, H. F., Sergeant, M. & Tyrrell, D. A. The time course of the immune response to experimental coronavirus infection of man. Epidemiol. Infect. 105, 435–446 (1990).CAS Article Google Scholar
- 16.Kaneko, N. et al. Loss of Bcl-6-expressing T follicular helper cells and germinal centers in COVID-19. Cell 183, 143–157 (2020).CAS Article Google Scholar
- 17.Wajnberg, A. et al. Robust neutralizing antibodies to SARS-CoV-2 infection persist for months. Science 370, 1227–1230 (2020).ADS CAS Article Google Scholar
- 18.Isho, B. et al. Persistence of serum and saliva antibody responses to SARS-CoV-2 spike antigens in COVID-19 patients. Sci. Immunol. 5, eabe5511 (2020).Article Google Scholar
- 19.Dan, J. M. et al. Immunological memory to SARS-CoV-2 assessed for up to 8 months after infection. Science 371, eabf4063 (2021).CAS Article Google Scholar
- 20.Gaebler, C. et al. Evolution of antibody immunity to SARS-CoV-2. Nature 591, 639–644 (2021).ADS CAS Article Google Scholar
- 21.Rodda, L. B. et al. Functional SARS-CoV-2-specific immune memory persists after mild COVID-19. Cell 184, 169–183 (2021).CAS Article Google Scholar
- 22.Davis, C. W. et al. Influenza vaccine-induced human bone marrow plasma cells decline within a year after vaccination. Science 370, 237–241 (2020).ADS CAS Article Google Scholar
- 23.Turesson, I. Distribution of immunoglobulin-containing cells in human bone marrow and lymphoid tissues. Acta Med. Scand. 199, 293–304 (1976).CAS Article Google Scholar
- 24.Pritz, T. et al. Plasma cell numbers decrease in bone marrow of old patients. Eur. J. Immunol. 45, 738–746 (2015).CAS Article Google Scholar
- 25.Shi, R. et al. A human neutralizing antibody targets the receptor-binding site of SARS-CoV-2. Nature 584, 120–124 (2020).ADS CAS Article Google Scholar
- 26.Cao, Y. et al. Potent neutralizing antibodies against SARS-CoV-2 identified by high-throughput single-cell sequencing of convalescent patients’ B cells. Cell 182, 73–84 (2020).CAS Article Google Scholar
- 27.Robbiani, D. F. et al. Convergent antibody responses to SARS-CoV-2 in convalescent individuals. Nature 584, 437–442 (2020).ADS CAS Article Google Scholar
- 28.Kreer, C. et al. Longitudinal isolation of potent near-germline SARS-CoV-2-neutralizing antibodies from COVID-19 patients. Cell 182, 843–854 (2020).CAS Article Google Scholar
- 29.Alsoussi, W. B. et al. A potently neutralizing antibody protects mice against SARS-CoV-2 infection. J. Immunol. 205, 915–922 (2020).CAS Article Google Scholar
- 30.Wang, C. et al. A human monoclonal antibody blocking SARS-CoV-2 infection. Nat. Commun. 11, 2251 (2020).ADS CAS Article Google Scholar
- 31.Wang, K. et al. Longitudinal dynamics of the neutralizing antibody response to severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) Infection. Clin. Infect. Dis. 2020, ciaa1143 (2020).Article Google Scholar
- 32.Chen, Y. et al. Quick COVID-19 healers sustain anti-SARS-CoV-2 antibody production. Cell 183, 1496–1507 (2020).CAS Article Google Scholar
- 33.Davis, C. W. et al. Longitudinal analysis of the human B Cell response to ebola virus infection. Cell 177, 1566–1582 (2019).CAS Article Google Scholar
- 34.Ellebedy, A. H. et al. Defining antigen-specific plasmablast and memory B cell subsets in human blood after viral infection or vaccination. Nat. Immunol. 17, 1226–1234 (2016).CAS Article Google Scholar
- 35.Stadlbauer, D. et al. SARS-CoV-2 seroconversion in humans: a detailed protocol for a serological assay, antigen production, and test setup. Curr. Protoc. Microbiol. 57, e100 (2020).CAS Article Google Scholar
Bestätigungen
Wir danken den Spendern für die Bereitstellung von Exemplaren; T. Lei für Unterstützung bei der Vorbereitung von Proben; und L. Kessels, A. J. Winingham, die Mitarbeiter der Clinical Research Unit für Infektionskrankheiten an der Washington University School of Medicine und das Pflegeteam der Knochenmarkbiopsie-Suite an der Washington University School of Medicine und dem Barnes Jewish Hospital für die Probenentnahme und die Versorgung von Spendern. Die SARS-CoV-2 S- und RBD-Proteinexpressionsplasmide wurden von F. Krammer zur Verfügung gestellt. Das Ellebedy-Labor wurde unterstützt durch die Zuschüsse des National Institute of Allergy and Infectious Diseases (NIAID) U01AI141990 und 1U01AI150747, NIAID Centers of Excellence for Influenza Research and Surveillance Verträge HHSN272201400006C und HHSN272201400008C und NIAID Collaborative Influenza Vaccine Innovation Centers Vertrag 75N93019C00051. J.S.T. wurde von NIAID 5T32CA009547 unterstützt. L.H. wurde durch den Zuschuss des norwegischen Forschungsrats 271160 und den Zuschuss der National Graduate School in Infection Biology and Antimicrobials 249062 unterstützt. Diese Studie verwendete Proben aus dem COVID-19-Biorepository der Washington University School of Medicine, das vom NIH-National Center for Advancing Translational Sciences Grant UL1 TR002345 unterstützt wird. Der Inhalt liegt allein in der Verantwortung der Autoren und stellt nicht unbedingt die Ansicht des NIH dar. Die Studien WU353, WU367 und WU368 wurden vom Washington University Institutional Review Board überprüft und genehmigt (Zulassungsnr. 202003186, 202009100 bzw. 202012081).
Informationen zum Autor
Zugehörigkeiten
- Abteilung für Pathologie und Immunologie, Washington University School of Medicine, St. Louis, MO, USAJackson S. Turner, Wooseob Kim, Aaron J. Schmitz, Lena Hansen & Ali H. Ellebedy
- Abteilung für Allergie und Immunologie, Abteilung für Innere Medizin, Washington University School of Medicine, St. Louis, MO, USAElizaveta Kalaidina
- Abteilung für Biostatistik, Washington University School of Medicine, St. Louis, MO, USACharles W. Goss
- Abteilung für Infektionskrankheiten, Abteilung für medizinische Medizin, Washington University School of Medicine, St. Louis, MO, USAAdriana M. Rauseo, Jane A. O’Halloran & Rachel M. Presti
- Influenza Centre, Department of Clinical Science, Universität Bergen, Bergen, NorwegenLena Hansen
- Abteilung für klinische Studien, Washington University School of Medicine, St. Louis, MO, USAAlem Haile & Michael K. Klebert
- Abteilung für Onkologie, Abteilung für Innere Medizin, Washington University School of Medicine, St. Louis, MO, USAIskra Pusic
- Zentrum für Impfstoffe und Immunität gegen mikrobielle Krankheitserreger, Washington University School of Medicine, St. Louis, MO, USARachel M. Presti und Ali H. Ellebedy
- Das Andrew M. und Jane M. Bursky Center for Human Immunology & Immunotherapy Programs, Washington University School of Medicine, St. Louis, MO, USAAli H. Ellebedy
Beiträge
A.H.E. konzipierte und gestaltete die Studie. J.S.T. und A.H.E. entwarfen Experimente und komponierten das Manuskript. A.H., M.K.K., I.P., J.A.O. und R.M.P. schrieben und pflegten das Institutional Review Board Protokoll, rekrutierten und phlebotomisierten Teilnehmer und koordinierten die Probenentnahme. J.S.T., W.K., E.K., A.J.S. und L.H. verarbeiteten Proben. A.J.S. exprimierte S- und RBD-Proteine. J.S.T., W.K. und E.K. führten ELISA und ELISpot durch. J.S.T. führte eine Durchflusszytometrie durch. J.S.T., A.M.R., C.W.G. und A.H.E. analysierten Daten. Alle Autoren überprüften das Manuskript.
Korrespondierender Autor
Ethik-Erklärungen
Konkurrierende Interessen
Das Ellebedy-Labor erhielt Mittel im Rahmen von gesponserten Forschungsvereinbarungen, die nichts mit den in der aktuellen Studie präsentierten Daten von Emergent BioSolutions und AbbVie zu tun haben. J.S.T., A.J.S. und A.H.E. sind Empfänger einer Lizenzvereinbarung mit Abbvie, die in keinem Zusammenhang mit den in der aktuellen Studie präsentierten Daten steht. A.H.E. ist Berater der Mubadala Investment Company und Gründer von ImmuneBio Consulting. Alle anderen Autoren erklären keine Interessenkonflikte.
Zusatzinformation
Peer-Review-Informationen Nature dankt Stanley Perlman, Andreas Radbruch und den anderen, anonymen Gutachtern für ihren Beitrag zum Peer Review dieser Arbeit. Peer-Reviewer-Berichte sind verfügbar.
Anmerkung des Herausgebers Springer Nature bleibt neutral gegenüber Zuständigkeitsansprüchen in veröffentlichten Karten und institutionellen Zugehörigkeiten.
Erweiterte Datenzahlen und Tabellen
Erweiterte Daten Abb. 1 Durchflusszytometrie-Identifizierung von SARS-CoV-2-ausgelösten Plasmazellen und Gedächtnis-B-Zellen.
a, d, Durchflusszytometrie-Gating-Strategien für BMPCs in magnetisch angereicherten BMPCs und Plasmablasten in PBMCs (a) und isotypgeschalteten Memory-B-Zellen und Plasmablasten in PBMCs (d).
b, Repräsentative Diagramme der intrazellulären SARS-CoV-2 S- und Influenzavirus-HA-Färbung in BMPCs aus Proben von Kontrollpersonen (links) und Personen, die sich 7 Monate nach Symptombeginn von COVID-19 (rechts) erholten.
c, Repräsentative Diagramme der intrazellulären S-Färbung in Plasmablasten in PBMCs eine Woche nach der Impfung gegen das saisonale Influenzavirus oder SARS-COV 2